Wstęp
Klasyczne wskazania do zapłodnienia pozaustrojowego In Vitro obejmują niedrożność jajowodów, umiarkowany czynnik męski oraz nieskuteczność dotychczas stosowanych sposobów leczenia. Metodę tę opracował zespół brytyjskich lekarzy i embriologów pod kierunkiem Edwardsa oraz Steptoe. W wyniku prowadzonych przez nich prac 25 lipca 1978 roku w Anglii urodziła się Luise Brown – pierwszy w historii ludzkości noworodek poczęty w wyniku pozaustrojowego zapłodnienia i przeniesienia rozwijającego się zarodka do jamy macicy. Skuteczność pierwszych prób, przeprowadzanych w cyklu naturalnym, była stosunkowo niska. Dopiero wprowadzenie stymulacji jajeczkowania, a wkrótce potem kontrolowanej hyperstymulacji jajników, znacznie ją zwiększyło.

Dzięki temu leczenie niepłodności metodą IVF szybko zdobyło uznanie na całym świecie. Po dziewięciu latach, 12 listopada 1987 roku, w Instytucie Położnictwa i Chorób Kobiecych w Białymstoku urodziło się pierwsze dziecko poczęte wskutek zapłodnienia in vitro wykonanego w Polsce. Obecnie IVF jest rozpowszechnioną na całym świecie, zaakceptowaną metodą leczniczą, a wskazania do jej stosowania obejmują niemal wszystkie czynniki etiologiczne niepłodności.
Wskazania
Wskazania do leczenia metodą zapłodnienia pozaustrojowego według najnowszych rekomendacji Polskiego Towarzystwa Medycyny Rozrodu obejmują:
1) Czynnik jajowodowy*
a) u pacjentek z trwałym uszkodzeniem jajowodów
b) u pacjentek zdyskwalifikowanych z leczenia operacyjnego
c) u pacjentek z upośledzoną funkcją jajowodów przy zachowanej drożności lub po operacji mikrochirurgicznej i upływie 2 lat bez ciąży; warunkiem zalecenia oczekiwania jest brak innych czynników mogących mieć wpływ na szansę na ciąże (nieprawidłowe nasienie, wiek kobiety > 35 lat, czas trwania niepłodności < 3 lat, endometrioza, zaburzenia jajeczkowania)
2) Niepłodność niewyjaśnionego pochodzenia **
a) jeżeli trwa > 3 lata
b) jeżeli wiek pacjentki > 35 lat – szybciej
3) Czynnik męski
a) całkowita liczba plemników ruchomych < 1 mln – wskazane ICSI
b) liczba plemników ruchomych 1 – 10 mln – w przypadku niepłodności dłuższej niż 2 lata**
c) liczba plemników > 10 mln – tak jak w niepłodności idiopatycznej
4) Endometrioza
a) I, II stopień, tak jak niepłodność niewyjaśnionego pochodzenia
b) III, IV stopień, tak jak czynnik jajowodowy
5) Zaburzenia hormonalne**
a) 12 cykli stymulowanych bez efektu
6) Nieudane próby inseminacji domacicznej
a) maksymalnie 6 prób < 35 roku życia
b) maksymalnie 4 próby > 35 roku życia
* wskazane jest usunięcie jajowodu w przypadku wodniaka
** powinno być rozważone wykonanie 4 – 6 inseminacji domacicznych przed IVF/ICSI
7) Obecnie leczenie metodą pozaustrojowego zapłodnienia stosuje się również u płodnych par, u których:
a) partner jest nosicielem wirusów HIV, HCV, a partnerka nie jest zarażona
b) para jest nosicielem zmian genetycznych powodujących ciężkie, nieodwracalne zmiany u potomstwa, a diagnostyka przedimplantacyjna pozwala uniknąć trudnej decyzji o przerwaniu ciąży
c) partnerka rozpoczyna leczenie przeciwnowotworowe i stosowane leczenie z dużym prawdopodobieństwem nieodwracalnie uszkodzi jajniki
d) przy indukcji jajeczkowania uzyskuje się dużą liczbę rozwijających się pęcherzyków i sytuacja ta powoduje duże ryzyko wystąpienia ciąży wielopłodowej.
Przebieg leczenia
Leczenie metodą pozaustrojowego zapłodnienia można podzielić na kilka etapów.
 – Farmakologiczna stymulacja jajników
– Farmakologiczna stymulacja jajników
Pierwszy z nich polega na farmakologicznej stymulacji jajników w celu uzyskania wzrostu i dojrzewania pęcherzyków Graafa. Większość badaczy zajmujących się leczeniem niepłodności jest zdania, że proces ten jest kluczowym elementem terapii. Wynik końcowy leczenia w dużym stopniu zależy od powodzenia indukcji jajeczkowania. W najczęściej obecnie stosowanych schematach stymulacji analogi GnRH podaje się jednocześnie z gonadotropinami. Przebieg stymulacji wymaga oceny ultrasonograficznej (ocena liczby i średnicy wzrastających pęcherzyków) i oznaczania stężeń estradiolu (E2) w surowicy krwi jako wykładnika endokrynnej funkcji rozwijających się pęcherzyków Graafa. Po uzyskaniu przez dominujące pęcherzyki przedowulacyjne wielkości >18 mm i średniego stężenia E2 na poziomie 150-200 pg/pęcherzyk, domięśniowe podanie 10 000 jednostek gonadotropiny kosmówkowej (hCG – human choriogonadotropin) symuluje egzogenny pik owulacyjny hormonu luteinizującego (LH – luteinizing hormone).
 – punkcja jajników
– punkcja jajników
Pobieranie komórek jajowych ma miejsce 34-36 godzin po podaniu hCG, na drodze punkcji pod kontrolą ultrasonografii. W tym celu wykorzystuje się sondy przezpochwowe (5-7,5 MHz) z prowadnicą do zabiegów wykonywanych przez tylne sklepienie pochwy. W uzyskanym płynie pęcherzykowym należy odszukać komórki jajowe i przenieść je do podłoża hodowlanego. Komórka jajowa jest otoczona wieńcem promienistym i komórkami wzgórka jajonośnego (OCCC – oocyte-corona radiata-cumulus complex). Morfologia OCCC, w ocenie stopnia rozproszenia wzgórka jajonośnego i wieńca promienistego, jest podstawą klasyfikacji jakości i stopnia dojrzałości komórki jajowej. Niedojrzałe genetycznie komórki jajowe, będące na etapie pęcherzyka zarodkowego (GV – germinal vesicle) i zaniku pęcherzyka zarodkowego (GVBD – germinal vesicle breakdown) nie są zdolne do zapłodnienia.
 – zapłodnienie komórek jajowych i rozwój zarodków
– zapłodnienie komórek jajowych i rozwój zarodków
Plemniki wykorzystywane w trakcie zapłodnienia in vitro są przygotowywane techniką migracji wstępującej lub wirowania na nieciągłym gradiencie Percollu. Przed inseminacją, komórki jajowe są inkubowane przez około 3 godziny, co umożliwia ich ostateczne dojrzewanie. Do oocytów umieszczonych w płytce hodowlanej dodaje się około 100 000 plemników, a po 19 godz. inkubacji ocenia się liczbę przedjądrzy (PN – pronucleus). Ich obecność świadczy o dokonanym zapłodnieniu. W prawidłowo zapłodnionych komórkach jajowych stwierdza się dwa przedjądrza, a w przestrzeni okołożółtkowej również dwa ciałka kierunkowe. Zapłodnione komórki są przenoszone do nowego podłoża. Około 5-10% komórek zapładnia się nieprawidłowo, o czym świadczy obecność więcej niż dwóch przedjądrzy. Należy je wyeliminować z dalszej hodowli. Około 28-32 godz. po zapłodnieniu dokonuje się pierwszy podział zarodkowy i widoczne są dwa blastomery. W drugiej dobie zarodki składają się z 3-5 komórek, po kolejnych 48-72 godzinach osiągają stadium moruli i blastocysty. Do jamy macicy mogą być przenoszone zarodki w 2, 3 lub 5-tej dobie po zapłodnieniu. W morfologicznej klasyfikacji zarodków ocenia się tempo podziałów komórkowych, symetryczność blastomerów i stopień ich fragmentacji. Największy potencjał rozwojowy wykazują zarodki o szybkim tempie podziałowym, zbudowane z równych blastomerów, niewykazujące fragmentacji. Szansa na uzyskanie ciąży zmniejsza się wraz ze wzrostem stopnia morfologicznych nieprawidłowości w zarodku.

 – transfer zarodka/ zardków
– transfer zarodka/ zardków
Historycznie do jamy macicy transferowano w zależności od standardów danego kraju i ośrodka, od jednego do czterech, a niekiedy nawet większą liczbę zarodków. Obecnie standardem stało się transferowanie pojedynczego zarodka kobietom do 35 roku życia i maksymalnie dwóch kobietom starszym. Takie postępowanie rekomenduje także Polskie Towarzystwo Medycyny Rozrodu, zgodnie z którego zaleceniami postępujemy w KRIOBANKU. Przeniesienie zarodków do macicy wykonuje się drogą przezszyjkową za pomocą specjalnych kateterów. Zarodki niewykorzystane do transferu są krioprezerwowane na etapie wczesnego rozwoju embrionalnego (4-6 blastomerów) lub po uzyskaniu stadium blastocysty w przedłużonej hodowli.
 – suplementacja fazy lutealnej
– suplementacja fazy lutealnej
Wszyscy autorzy są zgodni, że w wyniku programu zapłodnienia pozaustrojowego dochodzi do niewydolności lutealnej będącej konsekwencją zaburzeń wytwarzania ciałka żółtego. Wśród przyczyn tego faktu wymienia się aspirację komórek ziarnistych w trakcie zabiegowego pobierania komórek jajowych, jak również niskie stężenie LH wynikające z działania agonistów GnRH. Stąd też przyjętą praktyką jest suplementacja drugiej fazy cyklu gestagenami. W jej przebiegu stosuje się w drugiej fazie cyklu progesteron podawany domięśniowo w dawce 25 – 100 mg na dobę bądź też dopochwowo w dawce 90-600 mg na dobę. Innym rodzajem suplementacji jest przyjmowany doustnie dydrogesteron (Duphaston) lub też walerianian estradiolu z kapronianem 17 β-hydroksyprogesteronu (Gravibinon) podawany domięśniowo. Suplementacja drugiej fazy cyklu jest możliwa również przy pomocy hCG. W badaniach kontrolowanych największą skuteczność wykazano przy domięśniowym stosowaniu progesteronu i hCG oraz dopochwowej suplementacji pregesteronu.
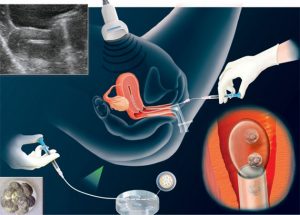
Docytoplazmatyczna iniekcja plemnika – ICSI
Wprowadzona przed ponad 10 laty metoda Docytoplazmatycznej Iniekcji Plemnika (ICSI – intracytoplasmic sperm injection) polega na bezpośrednim, mikrochirurgicznym wprowadzeniu gamety męskiej do cytoplazmy komórki jajowej. Pozwala to ominąć większość etapów naturalnej interakcji gamet, a tym samym wyeliminować niektóre przyczyny bezdzietności związane z czynnikiem męskim. Najczęstsze wskazania to mała liczba plemników (oligospermia), upośledzona ich ruchliwości (asthenospermia) oraz nieprawidłowa budowa (teratospermia), występujące w postaciach izolowanych oraz skojarzonych (OAT – oligoasthenoteratozoospermia). ICSI jest też jedyną metodą w przypadkach braku plemników w nasieniu (azoospermia), zarówno pochodzenia obturacyjnego jak i nieobturacyjnego oraz zaburzeń ejakulacji i nekrospermii.
 W zakresie indukcji jajeczkowania oraz uzyskania gamet żeńskich ICSI nie różni się istotnie w porównaniu do klasycznego IVF. W przypadku mężczyzn, których nasienie zawiera plemniki, przygotowanie nasienia obejmuje klasyczne techniki preparatywne, takie jak płukanie, migracja wstępująca czy też sedymentacja i rozdział w gradiencie percollu. W sytuacjach, gdy dostępne są jedynie pojedyncze gamety, płukanie i wirowanie ejakulatu jest metodą wystarczającą. W przypadkach azoospermii zaporowej plemniki uzyskuje się dzięki mikrochirurgicznej biopsji aspiracyjnej najądrzy (MESA – microsurgical epididymal sperm aspiration) lub jąder (TESA – testicular sperm aspiration). Pobrane drogą punkcji jajników oocyty poddawane są krótko trwałemu działaniu hialuronidazy celem usunięcia komórek ziarnistych tworzących wzgórek jajonośny oraz wieniec promienisty. Umożliwia to dokładną ocenę dojrzałości jądrowej oraz stanu ooplazmy.
W zakresie indukcji jajeczkowania oraz uzyskania gamet żeńskich ICSI nie różni się istotnie w porównaniu do klasycznego IVF. W przypadku mężczyzn, których nasienie zawiera plemniki, przygotowanie nasienia obejmuje klasyczne techniki preparatywne, takie jak płukanie, migracja wstępująca czy też sedymentacja i rozdział w gradiencie percollu. W sytuacjach, gdy dostępne są jedynie pojedyncze gamety, płukanie i wirowanie ejakulatu jest metodą wystarczającą. W przypadkach azoospermii zaporowej plemniki uzyskuje się dzięki mikrochirurgicznej biopsji aspiracyjnej najądrzy (MESA – microsurgical epididymal sperm aspiration) lub jąder (TESA – testicular sperm aspiration). Pobrane drogą punkcji jajników oocyty poddawane są krótko trwałemu działaniu hialuronidazy celem usunięcia komórek ziarnistych tworzących wzgórek jajonośny oraz wieniec promienisty. Umożliwia to dokładną ocenę dojrzałości jądrowej oraz stanu ooplazmy.
Oocyty znajdujące się w metafazie II-go podziału mejotycznego wykazują obecność I-go ciałka kierunkowego w przestrzeni okołożółtkowej i mogą być poddane bezpośrednio zabiegowi mikroiniekcji. Komórki jajowe o niewielkim stopniu niedojrzałości, znajdujące się w metafazie I-go podziału, po krótkotrwałej hodowli (6-12 godz) zazwyczaj uzyskują pełną dojrzałość in vitro. Oocyty będące w profazie pierwszego podziału mejotycznego nie uzyskują pełnej dojrzałości w warunkach in vitro i nie są zapładniane. W zasadniczej części zabiegu identyfikuje się plemnik o najkorzystniejszych parametrach budowy i ruchliwości, unieruchamia go poprzez uszkodzenie mechaniczne witki oraz wprowadza do wnętrza mikropipety iniekcyjnej. Pipetą trzymającą pozycjonuje się oocyt w taki sposób, by ciałko kierunkowe znajdowało się na godzinie dwunastej.
W tym położeniu wprowadzenie mikropipety iniekcyjnej ma miejsce na godzinie trzeciej w związku z pozycją wrzeciona kariokinetycznego II-go podziału mejotycznego, zlokalizowanego najczęściej pod ciałkiem kierunkowym. Bezpośrednio po spenetrowaniu osłonki przejrzystej aspiruje się ooplazmę do wnętrza pipety, co umożliwia przerwanie oolemmy i zdeponowanie plemnika w ooplazmie. Powolne wyprowadzenie pipety powinno umożliwić zapoczątkowanie procesów reperacyjnych oolemmy. W 9.-12. godzinie od zabiegu możliwa jest zazwyczaj ocena aktywacji jaja oraz przebiegu zapłodnienia. Dalsze etapy postępowania są analogiczne jak w przypadku klasycznej metody in vitro i obejmują obserwację rozwoju zarodkowego, wybór zarodków o największym potencjale rozwojowym i ich przeniesienie do macicy, krioprezerwację zarodków nadliczowych oraz suplementację fazy lutealnej.
TESA / PESA
Niekiedy w nasieniu męskim w ogóle nie znajdujemy plemników. Ważna jest wówczas odpowiedź na pytanie: czy jądra mężczyzny produkują plemniki?
Pomocna jest wstępna analiza poziomu hormonów oraz ocena wielkości i konsystencji jąder. W większości przypadków konieczna jest również diagnostyka genetyczna mężczyzny i kobiety, pozwalająca na ocenę ryzyka wystąpienia zaburzeń genetycznych u potomstwa. Jeżeli wyniki badań są pozytywne, przeprowadzamy zabieg biopsji cienkoigłowej jąder lub najądrzy. Odbywa się on w znieczuleniu ogólnym, jest więc bezbolesny i mało obciążający dla mężczyzny. Już po godzinie może on opuścić klinikę. Jeśli uzyskany w wyniku biopsji materiał zawiera żywe plemniki, to możliwe jest zapłodnienie techniką mikroiniekcji do wnętrza komórki jajowej, opisane powyżej. W każdym przypadku uzyskane plemniki z jąder lub najądrzy zamraża się, celem późniejszego wykorzystania. W razie braku żywych plemników pozostaje jedynie skorzystanie z nasienia dawcy lub adopcja.
IMSI
(z ang. Intracytoplasmic Morphologically Selected Sperm Injection), oznacza docytoplazmatyczną iniekcję plemnika, wyselekcjonowanego pod względem morfologicznym za pomocą techniki dużych powiększeń i wysokiej rozdzielczości. Metoda IMSI jest oparta na metodzie ICSI, różni się sposobem wyboru plemnika, który zostanie użyty do mikromanipulacji.
Skuteczność leczenia z zastosowaniem zapłodnienia pozaustrojowego, jakkolwiek bardzo wysoka, jest ciągle niezadawalająca w niektórych grupach pacjentów. Dlatego też na całym świecie wdrażane są nowe metody mogące wpłynąć korzystnie na wyniki kliniczne. Zastosowanie nieinwazyjnych, pozbawionych ryzyka rozwiązań niosących poprawę dotychczasowych wyników jest idealnym rozwiązaniem. Metoda IMSI jest tego najlepszym przykładem.

Coraz częściej w leczeniu niepłodności, aby zwiększyć szansę zapłodnienia, stosuje się metody preparatywne pozwalające na uzyskanie frakcji plemników o najlepszych parametrach jakościowych. Jest to szczególnie ważne przy zastosowaniu procedury docytoplazmatycznej iniekcji plemnika (ICSI). Wyboru plemników dokonuje się na podstawie ich budowy oraz paramtrów ruchu. Jednak w pewnych przypadkach niepłodności męskiej, przy pomocy normalnego wyposażenia technicznego do ICSI, wybór prawidłowego plemnika przez embriologa może być utrudniony. Dzięki IMSI przed iniekcją plemnika do komórki jajowej ocenia się jego główkę (jądro) pod bardzo dużym powiększeniem, co zdecydowanie ułatwia wybór.
Zastosowanie IMSI zwiększa również szanse w sytuacji słabej odpowiedzi jajników na stymulację. Uzyskanie małej liczby oocytów stwarza ryzyko, że po ich zapłodnieniu nie uzyskamy zadowalającej liczby prawidłowych zygot. Metoda IMSI poprzez możliwość wybierania najlepszych plemników poprawia szansę na uzyskanie prawidłowych zarodków, a przez to szansę na ciążę.
Badania kliniczne potwierdzają, że zastosowane metody IMSI wpływa na poprawę wskaźników ciąż a także redukuje odsetek poronień. Procedura jest zalecana szczególnie dla par po wcześniejszych niepowodzeniach procedury ICSI, przy ciężkim czynniku męskim niepłodności, przy poronieniach w wywiadzie.
Na poniższych zdjęciach przedstawiono porównanie obrazowania plemnika przy metodzie ICSI i IMSI. Dzięki tak dużemu powiększeniu stosowanemu w metodzie IMSI, możemy dokładnie ocenić strukturę morfologiczną plemnika i wybrać tego o idealnej budowie.
EMBRIOSKOP
Jest urządzeniem umożliwiającym stałą obserwację rozwoju zarodków od momentu zapłodnienia oocytu do czasu jego przeniesienia do macicy lub krioprezerwacji. Pobrane podczas punkcji jajników komórki jajowe są zapładniane w laboratorium embriologicznym a następnie umieszczane w odpowiednich podłożach hodowlanych i wstawiane do inkubatora CO2. Panująca tam temperatura, wilgotność oraz skład gazów zapewniają optymalne warunki dla rozwoju zarodków. Zadaniem embriologa jest ocena tempa podziałowego zarodka, określanie liczby i symetrii dzielących się komórek (blastomerów), stopnia fragmentacji zarodków wczesnych oraz prawidłowość budowy zarodka w piątej dobie rozwoju (blastocysty). Należy podkreślić że rozwój zarodkowy jest procesem niezwykle dynamicznym a zachodzące w nim zmiany są bardzo szybkie. Z tego powodu klasyczna, jednorazowa ocena zarodka pod mikroskopem w czasie 24 godzin hodowli, nie pozwala zauważyć wielu, niekiedy kluczowych szczegółów rozwoju, determinujących potencjał rozwojowy zarodka. Częstsza ocena, związana z wyjmowaniem zarodków z inkubatora i obserwacją pod mikroskopem może niekorzystnie wpłynąć na jego rozwój w związku z niestabilnymi warunkami hodowli.

W chwili obecnej możliwa jest ciągła, automatyczna obserwacja oraz dokumentacja rozwoju zarodków bez konieczności wyjmowania ich z inkubatora. Pozwala na to technika time-lapsowa. Embrioskop- to najbardziej zaawansowany w chwili obecnej system do hodowli i ciągłej obserwacji rozwoju zarodków. Wewnątrz urządzenia umieszczona jest kamera, która automatycznie, co kilka minut, fotografuje zarodki. Uzyskane zdjęcia składają się na szczegółowy film z całego rozwoju zarodkowego. Analiza powstałego filmu ułatwia wybór zarodków o najlepszej dynamice podziałowej i morfologii a tym samym największym potencjale rozwojowym. Pozwala też zidentyfikować zarodki nieprawidłowe. Dzięki tej metodzie możliwe jest ograniczenie liczby przenoszonych do macicy zarodków bez zmniejszenia skuteczności leczenia a także pozwala uniknąć ryzyka ciąż wielopłodowych. Zarodki o prawidłowym rozwoju, które nie zostały przeniesione do macicy, zamraża się celem późniejszego wykorzystania w przyszłych cyklach. Istnieje możliwość analizy filmu wraz z pacjentami co pomaga zrozumieć wystepujące problemy związane ze skutecznościa leczenia.
Z metody tej mogą korzystać wszystkie pary, jednak szczególnie polecana jest u kobiet w późnym wieku oraz po wielokrotnych niepowodzeniach leczenia IVF. Z naszych doświadczeń wynika, że zastosowanie tej metody przyczynia się do uzyskiwania zdecydowanie lepszych wyników leczenia.
Nacięcie otoczki przejrzystej zarodka
Udana implantacja czyli zagnieżdżenie zarodka w błonie śluzowej macicy (endometrium) zależy, między innymi, od sprawnie przebiegającego procesu jego wykluwania się (hatching) z osłonki przejrzystej (zona pellucida – ZP). Umożliwia to bezpośredni kontakt blastocysty (zarodek w stadium rozwoju zdolnym do implantacji) z endometrium. Blastocysta rozpręża się i napiera od wewnątrz na osłonkę, która ulega przerwaniu i umożliwia blastocyście całkowite opuszczenie osłonki. Zjawisko to nazywa się wykluwaniem blastocysty (blastocyst hatching). Czasami nie dochodzi do przerwania osłonki przejrzystej co uniemożliwia interakcję zarodka z endometrium a przez to implantację i rozwój ciąży. Badania naukowe jak również obserwacje kliniczne wykazują, że przyczyn tego stanu rzeczy należy szukać w czynnikach morfologicznych takich jak: ponadprzeciętna grubość osłonki przejrzystej, fragmentacja zarodka czy też zbyt mała liczba blastomerów (komórek), z których złożony jest zarodek. Do innych czynników utrudniających wyklucie się blastocysty należy prawdopodobnie wiek pacjentek i związane z nim zjawisko twardnienia osłonki (zona hardening). Dowiedziono też, że mrożenie i rozmrażanie zarodków może być przyczyną występowania tego zjawiska.
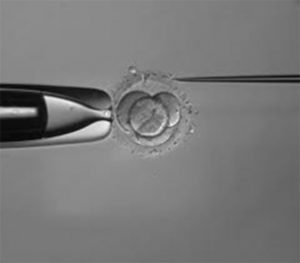
Assisted hatching jest metodą laboratoryjną, która polega na pocienieniu lub całkowitym przerwaniu ciągłości osłonki przejrzystej otaczającej zarodek. Zabieg ten ułatwia blastocyście „wyklucie się” przez co zwiększa szansę na udaną implantację w błonie śluzowej macicy. Wykonuje się go tuż przed transferem- dotyczy to zarówno zarodków świeżych jak i mrożonych. Ryzyko uszkodzenia zarodka jest bardzo małe. Dane literaturowe przemawiają jednak za zwiększoną częstością występowania ciąż bliźniaczych jednojajowych po tym zabiegu.
Wskazania do tego zabiegu obejmują:
- wiek kobiety: powyżej 37-39 roku życia
- kobiety z podwyższonym poziomem FSH w 1-3 dniu cyklu
- morfologia zarodka: np. zbyt gruba zewnętrzna osłonka przejrzysta, opóźnione podziały komórkowe lub wysoki odsetek fragmentacji komórkowej
- w cyklach po wcześniejszych niepowodzeniach leczenia IVF
- przed kriotransferem
Ocena czynności skurczowej macicy
Transfer zarodków do macicy jest końcowym etapem leczenia metodą zapłodnienia pozaustrojowego. Ta krótka procedura jest uwieńczeniem czasochłonnych przygotowań, czasami uciążliwej stymulacji, punkcji jajników, potem całego etapu embriologicznego. Na udaną implantację zarodków po transferze wpływają głównie jakość zarodków oraz tzw. receptywność macicy czyli „chęć macicy do ich przyjęcia”. Równie istotne jednak są jakość wykonania zabiegu i warunki dla przyjęcia zarodka. Kluczowym elementem warunkującym możliwość implantacji może być nadmierna (ponad 3 skurcze/3min) czynność skurczowa macicy. Nasilone skurcze macicy, zarówno spontaniczne jak i indukowane urazowym zabiegiem, mogą zmniejszać szanse na zagnieżdżenie zarodka w cyklach IVF-ET powodując usunięcie zarodków z macicy po transferze.
Nadmierna czynność skurczowa macicy obecna jest u około 1/3 pacjentek leczonych metodą IVF-ET. Wyniki leczenia (odsetek ciąż) uzyskiwane w tej grupie pacjentek są nawet 3-krotnie mniejsze w porównaniu do pacjentek z normalną czynnością. Jak wiadomo, skurcze macicy uwarunkowane są pobudzeniem receptorów oksytocynowych co stwarza możliwość farmakologicznej interwencji. Wykazano, że użycie antagonistów receptora oksytocynowego (Atosiban) zmniejsza czynność skurczową macicy i wpływa korzystnie na implantację zarodków. Wykazano też, że atosiban nie wywiera efektów embriotoksycznych i jego podanie podczas transferu jest bezpieczne. Wstępne wyniki kliniczne z badań nad użyciem tego leku wskazują na zwiększenie odsetków ciąż u pacjentek leczonych w programie IVF-ET. Po okresie wstępnych badań naukowych w naszym ośrodku wprowadziliśmy tę procedurę jako rutynowe postepowanie u pacjentek ze zdiagnozowaną nadmierną czynnością skurczową.

 Zastosowanie techniki ultrasonografii trójwymiarowej (3D) pozwoliło na ominięcie wielu ograniczeń projekcji dwuwymiarowej. Technika 3D pozwala na zapisanie bardzo dużej serii sekwencyjnych obrazów ultrasonograficznych złożonych w plik objętościowy, który może zostać zarchiwizowany i poddany obróbce w późniejszym okresie. Przezpochwowe USG 3D pozwala na jednoczesne uwidocznienie danego narządu w trzech prostopadłych płaszczyznach, na dokonanie dokładnych pomiarów wymiarów i objętości przy równoczesnych zobrazowaniu zewnętrznych konturów badanej struktury. Zapisany obraz objętościowy może być obracany i oglądany we wszystkich płaszczyznach. W medycynie rozrodu ultrasonografia 3D ma wiele potencjalnych zastosowań między innymi do oceny wad wrodzonych i nabytych macicy, badania drożności jajowodów, obserwacji jajników i ich odpowiedzi na stymulację jajeczkowania oraz oceny receptywności błony śluzowej macicy. Dodatkowo trójwymiarowa angiografia Power Doppler pozwala na ocenę przepływów objętościowych w jajniku i endometrium.
Zastosowanie techniki ultrasonografii trójwymiarowej (3D) pozwoliło na ominięcie wielu ograniczeń projekcji dwuwymiarowej. Technika 3D pozwala na zapisanie bardzo dużej serii sekwencyjnych obrazów ultrasonograficznych złożonych w plik objętościowy, który może zostać zarchiwizowany i poddany obróbce w późniejszym okresie. Przezpochwowe USG 3D pozwala na jednoczesne uwidocznienie danego narządu w trzech prostopadłych płaszczyznach, na dokonanie dokładnych pomiarów wymiarów i objętości przy równoczesnych zobrazowaniu zewnętrznych konturów badanej struktury. Zapisany obraz objętościowy może być obracany i oglądany we wszystkich płaszczyznach. W medycynie rozrodu ultrasonografia 3D ma wiele potencjalnych zastosowań między innymi do oceny wad wrodzonych i nabytych macicy, badania drożności jajowodów, obserwacji jajników i ich odpowiedzi na stymulację jajeczkowania oraz oceny receptywności błony śluzowej macicy. Dodatkowo trójwymiarowa angiografia Power Doppler pozwala na ocenę przepływów objętościowych w jajniku i endometrium.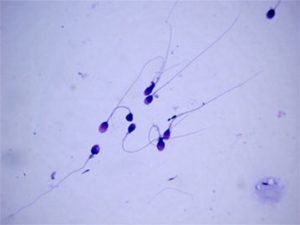 Rutynowo badanie nasienia odbywało się przy zastosowaniu mikroskopu optycznego. Niestety jest to ocena subiektywna, i tak jak nie sprawia raczej trudności w ocenie liczby plemników, dość często mogą pojawiać się odstępstwa przy ocenie ich ruchomości. Brak możliwości obiektywnej analizy odsetka plemników ruchomych zaowocował stworzeniem systemu komputerowo wspomaganej analizy nasienia – computer assisted sperm analysis (CASA).System ten składa się oz połączenia mikroskopu z kontrastem fazowym, kamery, komputera oraz specjalistycznego oprogramowania. Pozwala to na uwidocznienie kolejnych pozycji plemnika z częstością 5-60 obrazów w jednej sekundzie i transformację zapisanych obrazów w formę cyfrową. Jest ona poddawana analizie komputerowej pozwalającej na dokładną i obiektywną analizę trajektorii ruchu każdego plemnika.
Rutynowo badanie nasienia odbywało się przy zastosowaniu mikroskopu optycznego. Niestety jest to ocena subiektywna, i tak jak nie sprawia raczej trudności w ocenie liczby plemników, dość często mogą pojawiać się odstępstwa przy ocenie ich ruchomości. Brak możliwości obiektywnej analizy odsetka plemników ruchomych zaowocował stworzeniem systemu komputerowo wspomaganej analizy nasienia – computer assisted sperm analysis (CASA).System ten składa się oz połączenia mikroskopu z kontrastem fazowym, kamery, komputera oraz specjalistycznego oprogramowania. Pozwala to na uwidocznienie kolejnych pozycji plemnika z częstością 5-60 obrazów w jednej sekundzie i transformację zapisanych obrazów w formę cyfrową. Jest ona poddawana analizie komputerowej pozwalającej na dokładną i obiektywną analizę trajektorii ruchu każdego plemnika. Badania hormonalne mają również dużą wartość przy ocenie jakości owulacji i jej potwierdzeniu. Z dużym prawdopodobieństwem można mówić o występowaniu u kobiety cykli owulacyjnych jeżeli miesiączkuje ona regularnie w rytmie od 21 do 35 dni, potwierdza to badanie ultrasonograficzne, wykazujące obecność rosnącego pęcherzyka, osiągającego w okresie okołoowulacyjnym średnicę 16-22 mm oraz oznaczenie stężenia estradiolu w okresie okołoowulacyjnym (150 – 300pg/ml) i progesteronu w surowicy krwi na siedem dni przed spodziewaną miesiączką ( powyżej 10ng/ml).
Badania hormonalne mają również dużą wartość przy ocenie jakości owulacji i jej potwierdzeniu. Z dużym prawdopodobieństwem można mówić o występowaniu u kobiety cykli owulacyjnych jeżeli miesiączkuje ona regularnie w rytmie od 21 do 35 dni, potwierdza to badanie ultrasonograficzne, wykazujące obecność rosnącego pęcherzyka, osiągającego w okresie okołoowulacyjnym średnicę 16-22 mm oraz oznaczenie stężenia estradiolu w okresie okołoowulacyjnym (150 – 300pg/ml) i progesteronu w surowicy krwi na siedem dni przed spodziewaną miesiączką ( powyżej 10ng/ml). Podstawowe wskazania do oceny hormonalnej to azoospermia (brak plemników w ejakulacie) i oligozoospermia < 5 mln plemników w 1 ml nasienia. Minimum diagnostyczne powinno obejmować pomiar stężenia FSH i testosteronu w surowicy. W przypadku objawów hipoandrogennych oprócz oceny FSH należy zbadać poziom inhibiny, LH, estradiolu i prolaktyny.
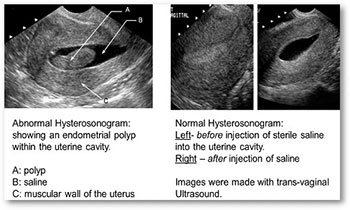
Podstawowe wskazania do oceny hormonalnej to azoospermia (brak plemników w ejakulacie) i oligozoospermia < 5 mln plemników w 1 ml nasienia. Minimum diagnostyczne powinno obejmować pomiar stężenia FSH i testosteronu w surowicy. W przypadku objawów hipoandrogennych oprócz oceny FSH należy zbadać poziom inhibiny, LH, estradiolu i prolaktyny. Histeroskopia diagnostyczna – jest szczególnie istotnym badaniem w diagnostyce patologii błony śluzowej jamy macicy. Poprzez zastosowanie histeroskopu, specjalnego urządzenia optycznego wyposażonego w światłowód, możliwa jest dokładna ocena kanału szyjki macicy oraz jamy macicy.
Histeroskopia diagnostyczna – jest szczególnie istotnym badaniem w diagnostyce patologii błony śluzowej jamy macicy. Poprzez zastosowanie histeroskopu, specjalnego urządzenia optycznego wyposażonego w światłowód, możliwa jest dokładna ocena kanału szyjki macicy oraz jamy macicy.